Zusammenfassung: In der CREDENCE-Studie senkte der SGLT2-Inhibitor Canagliflozin in Kombination mit einem ACE-Hemmer bei Patienten mit Typ-2-Diabetes und relevanter Proteinurie die Wahrscheinlichkeit für renale Komplikationen. Dieser Effekt trat unabhängig vom Ausmaß der Senkung von Blutzucker, Blutdruck und Körpergewicht auf. Auch eine signifikante Reduktion kardiovaskulärer Ereignisse war nachweisbar. Gleichsinnige Ergebnisse gibt es auch für andere SGLT2-Hemmer (Dapagliflozin, Empagliflozin). Somit dürfte es sich bei der Reduktion kardiorenaler Ereignisse um einen Klasseneffekt der SGLT2-Inhibitoren handeln. Auch in der CREDENCE-Studie wurden vermehrt euglykämische Ketoazidosen und Genitalinfektionen beobachtet. Während die Nutzen-Risiko-Relation unter Studienbedingungen günstig erscheint, könnte die breite Anwendung dieser Wirkstoffgruppe bei älteren und morbiden Patienten im „realen Leben“ wesentlich problematischer sein.
Eine gute Kontrolle von Blutzucker und Blutdruck verlangsamt, aber verhindert nicht Nierenschäden bei Diabetikern. Als evidenzbasierter Behandlungsansatz zur Verzögerung einer diabetischen Nephropathie (sog. „Nephroprotektion“) stehen bislang nur Hemmstoffe des Renin-Angiotensin-Aldosteron-Systems (RAAS) zur Verfügung (1). Seit längerem gibt es Hinweise darauf, dass auch das Inkretinmimetikum Liraglutid und Inhibitoren des renalen Natrium(Sodium)-Glukose-Cotransporters-2 (SGLT2-Inhibitoren) nicht nur die kardiovaskulären, sondern auch die renalen Komplikationen bei Typ-2-Diabetikern senken (2). So zeigte sich in der 2017 publizierten CANVAS-Studie (3) mit über 10.000 Typ-2-Diabetikern (primärer Studienendpunkt kardiovaskulärer Tod, nicht tödlicher Myokardinfarkt oder nicht tödlicher Schlaganfall), dass mit Canagliflozin (Can) im Vergleich zu Plazebo signifikant seltener ein vordefinierter kombinierter nierenspezifischer Endpunkt auftrat (40%ige Minderung der GFR, Notwendigkeit einer Nierenersatztherapie oder Tod aus renalen Ursachen: Hazard Ratio = HR: 0,60; 95%-Konfidenzintervall = CI: 0,47-0,77) und dass die Albuminurie seltener zunahm (HR: 0,73; CI: 0,67-0,79).
Diesen positiven Effekten stehen jedoch bedeutsame Nebenwirkungen gegenüber: Bei SGLT2-Inhibitioren betragen die Therapie-Abbruchraten 25-30%, und es gibt Rote-Hand-Briefe und Risikosignale zu vermehrten genitalen Infektionen, Fournier-Gangrän (4), euglykämischen Ketoazidosen (5) sowie Amputationen im Bereich der unteren Extremitäten (6). Deshalb war für uns die Nutzen-Risiko-Relation weiterhin unklar (7).
Nun wurde im N. Engl. J. Med. die multizentrische CREDENCE-Studie publiziert (8), in der die Beobachtungen aus der CANVAS-Studie aufgenommen und speziell die Wirkungen des SGLT2-Inhibitors Can auf die Nierenfunktion von Typ-2-Diabetikern untersucht wurden. Die Studie wurde vom Zulassungsinhaber Janssen Cilag finanziert. Die Bedeutung dieser Studie für Patienten und ihre behandelnden Ärzte könne laut der beiden Kommentatoren Julie Ingelfinger von der Tufts University in Boston und Clifford Rosen vom Center for Clinical and Translational Research in Scarborough nicht überbewertet werden (9).
Can wurde 2014 von der Europäischen Arzneimittel-Agentur (EMA) als zweiter SGLT2-Inhibitor nach Dapagliflozin zur Mono- und Kombinationstherapie bei erwachsenen Patienten mit Typ-2-Diabetes zugelassen. Can hat jedoch nach gültiger Beschlusslage des Gemeinsamen Bundesausschusses (G-BA) keinen Zusatznutzen (10). Der pharmazeutische Unternehmer (pU) Janssen Cilag konnte keine Belege vorlegen, dass Can als Monotherapie gegenüber einer zweckmäßigen Vergleichstherapie (Sulfonylharnstoffe) Vorteile hat. Dieser Beschluss hat dazu geführt, dass der Janssen Cilag nicht den erhofften Preis erzielen konnte und das Medikament in Deutschland wieder vom Markt genommen hat. In Österreich befindet sich Can in der gelben Box, d.h. es muss im Einzelfall bewilligt werden. Andere SGLT2-Hemmer wurden in der Nutzenbewertung des G-BA ähnlich eingestuft wie Can, jedoch haben sich deren pU mit einem um 40-50% geringeren Preis abgefunden (11).
Can darf – wie alle SGLT2-Inhibitoren – laut Fachinformationen nur bei Patienten mit einer Kreatinin-Clearance (CrCl) > 60 ml/min und somit bislang nicht bei fortgeschrittener Niereninsuffizienz angewendet werden. Bei Patienten, die bereits auf Can eingestellt sind, dieses vertragen und deren CrCl auf < 60 ml/min abfällt, soll die Dosis 100 mg/d nicht überschreiten. Bei einer anhaltenden CrCl < 45 ml/min muss Can abgesetzt werden. Bei Patienten mit terminaler Niereninsuffizienz oder Dialysepflicht ist auf Grund des Wirkmechanismus der SGLT2-Inhibitoren keine blutzuckersenkende Wirkung mehr zu erwarten (12).
Ein- und Ausschlusskriterien: In die CREDENCE-Studie wurden Typ-2-Diabetiker (HbA1c-Wert: 6,5%-12,0%, in Deutschland 6,5%-10,5%) mit einer reduzierten GFR (≥ 30 bis < 90 ml/min) und einer Proteinurie (Albumin/Kreatinin-Ratio im Urin 300-5.000 mg/g) eingeschlossen. Bei 60% der Patienten sollte die GFR < 60 ml/min liegen. Ausgeschlossen wurden u.a. Patienten mit einer nicht diabetischen Nephropathie, Typ 1-Diabetes, unkontrollierter Hypertonie, Kaliumwerten > 5,5 mmol/l, > 2fach erhöhter ALAT bzw. > 1,5fach erhöhter Bilirubinwerte, einer Vorgeschichte mit diabetischer Ketoazidose, Hämodialyse oder Nierentransplantation sowie einer unzureichenden Arzneimitteladhärenz. Diese wurde in einer 2-wöchigen, einfach verblindeten Plazebo-Run-In-Phase getestet. Alle Patienten mussten eine stabile Dosis eines ACE-Hemmers oder Angiotensin-II-Rezeptorblockers einnehmen (maximal tolerierte Dosis für mindestens 4 Wochen).
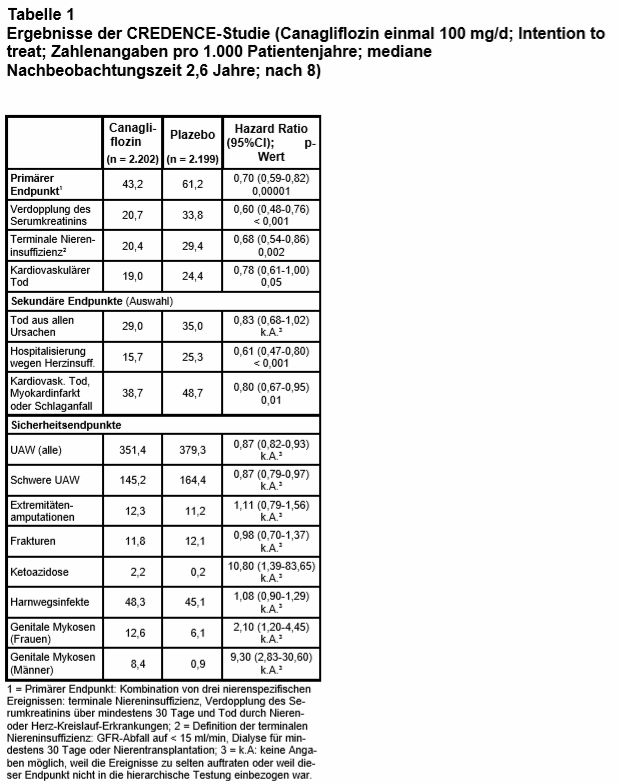
Intervention und Endpunkte: Die Studienteilnehmer erhielten doppelblind zu ihrer üblichen Therapie entweder Can (einmal 100 mg/d oral) oder Plazebo. Die Randomisierung erfolgte innerhalb von 3 Blöcken, je nach Ausgangs-GFR (30-< 45 ml, 45-< 60 ml und 60-< 90 ml/min). Primärer Studienendpunkt war eine Kombination von drei nierenspezifischen Ereignissen: 1. terminale Niereninsuffizienz (definiert als GFR-Abfall auf < 15 ml/min, Dialyse für mindestens 30 Tage oder Nierentransplantation), 2. Verdopplung des Serumkreatinins über mindestens 30 Tage oder 3. Tod durch Nieren- oder Herz-Kreislauf-Erkrankungen. Darüber hinaus gab es mehrere kombinierte sekundäre Endpunkte wie die kardiovaskulären Ereignisraten und Sicherheitsendpunkte, darunter Amputationen im Bereich der Extremitäten, Ketoazidosen, Harnwegs- und Genitalinfektionen.
Es sollten mindestens 4.200 Patienten eingeschlossen werden, um einen 20%igen Vorteil von Can gegenüber Plazebo erkennen zu können. Die Nachbeobachtung sollte so lange durchgeführt werden bis 844 Endpunkt-Ereignisse erreicht sind. Bei einer geplanten Zwischenanalyse nach 585 Ereignissen wurde die Studie jedoch durch ein unabhängiges Data Monitoring Committee vorzeitig abgebrochen, da der Unterschied zwischen Can und Plazebo eine vordefinierte Grenze überschritten hatte.
Ergebnisse: Zwischen 2014 und 2017 wurden an 690 Standorten in 34 Ländern insgesamt 12.900 Patienten gescreent und 4.401 Patienten randomisiert (34,1% aller gescreenten). Das mittlere Alter betrug 63 Jahre, 33,9% waren Frauen. Der durchschnittliche HBA1c-Wert betrug bei Studienbeginn 8,3%, die mittlere GFR 56,2 ml/min, die mediane Albumin/Kreatinin-Ratio im Urin 927 mg/g. Bei 29% lag die GFR zwischen 30-44 ml/min (n = 1.313), bei weiteren 29% zwischen 45-59 ml/min (n = 1.279) und bei 41% zwischen 60-89 ml/min (n = 1.809). Die Grundrisiken waren in den beiden Studienarmen gleich verteilt: die Diabetesdauer betrug durchschnittlich 15,8 Jahre und der BMI 31,3 kg/m2; eine arterielle Hypertonie hatten 96,8% und eine manifeste kardiovaskuläre Erkrankung 50,4%. Die antidiabetische Begleittherapie bestand aus: Insulin (65,5%), Metformin (57,8%), Sulfonylharnstoffen (28,8%), Hemmern der Dipeptidylpeptidase 4 (DPP4-Inhibitoren = Gliptine; 17,1%), Glucagon-like Peptid-1-Rezeptor-Agonisten (Inkretinmimetika; 4,2%) und anderen oralen Antidiabetika (6,3%).
Bei Studienabbruch betrug die mediane Nachbeobachtung 2,62 Jahre (Spanne 0,02-4,53), und der Gesundheitsstatus war bei allen bis auf 6 Patienten bekannt. Insgesamt 1.201 Patienten (27,3%) hatten die Studienmedikation abgesetzt (Can: 24,7% vs. Plazebo: 29,9%), meist wegen unerwünschter Ereignisse (12% vs. 13%) oder aus „persönlichen Gründen“ (7,5% vs. 9,1%).
Der primäre Endpunkt trat mit Can signifikant seltener auf als mit Plazebo, die relative Risikoreduktion wird mit 30% berechnet (s. Tab. 1). Der Effekt war in allen Regionen und untersuchten Subgruppen ähnlich, wenngleich nicht immer signifikant unterschiedlich. So war der Nutzen bei den europäischen Patienten (n = 864) geringer (18% Risikoreduktion) und das CI sehr weit (HR: 0,82; CI: 0,54-1,24). Can war auch bei den Patienten mit der niedrigsten Ausgangs-GFR (30-44 ml/min) effektiv (Ereignisrate 72,2 vs. 95,4/1.000 Patientenjahre; HR: 0,75; CI: 0,59–0,95).
Can führte auch bei vielen untersuchten sekundären Endpunkten (alles kombinierte Ereignisse) zu einem signifikant besseren Ergebnis. Nicht signifikant unterschiedlich waren die beiden Behandlungsstrategien jedoch beim Endpunkt Tod aus allen Ursachen: 29,0% vs. 35,0% (HR: 0,83; CI: 0,68-1,02).
Weitere Unterschiede zu Gunsten von Can fanden sich bei der Senkung des HbA1c-Werts (Differenz: 0,25 Prozentpunkte), des systolischen (Differenz: 3,3 mm Hg) und des diastolischen Blutdrucks (Differenz: 0,95 mm Hg) und des Körpergewichts (Differenz: 0,80 kg). Die pathophysiologisch vielleicht wichtigste Beobachtung ist, dass die Proteinurie mit Can am Studienende um 31% niedriger war als zu Beginn; mit Plazebo blieb sie gleich.
Unerwünschte Ereignisse: Diese wurden in der Can-Gruppe ähnlich häufig beobachtet wie in der Plazebo-Gruppe (s. Tab. 1). Es zeigte sich weder ein signifikanter Unterschied bei der Häufigkeit von Harnwegsinfekten, von Amputationen im Bereich der Extremitäten noch bei Frakturen. Diabetische Ketoazidosen und genitale Mykosen waren mit Can jedoch deutlich häufiger. Jedes Jahr wäre demnach bei 1 von 450 mit Can behandelten Patienten mit einer lebensbedrohlichen Ketoazidose zu rechnen. Es ist zu befürchten, dass dieser Wert im realen Leben noch höher ist als in Studien – aufgrund der Behandlung älterer und sehr morbider Patienten sowie nicht ausreichender Beachtung der Nebenwirkungen durch die behandelnden Ärzte. Angaben über die Häufigkeit von Ketoazidosen und anderen Nebenwirkungen in Abhängigkeit vom Stadium der Niereninsuffizienz werden leider nicht mitgeteilt.
Diskussion: Die Autoren berechnen auf der Basis dieser Ergebnisse, dass durch eine 2,5-jährige Therapie mit Can bei 1.000 Patienten 47 primäre Endpunktereignisse verhindert werden können, was einer Number Needed to Treat (NNT) von 22 entspricht, darunter 24 terminale Nierenerkrankungen (NNT: 43). Zudem könnten 22 Krankenhausaufenthalte wegen Herzinsuffizienz verhindert werden (NNT: 46) und 25 weitere kardiovaskuläre Ereignisse (NNT: 40). Da alle diese Effekte unabhängig vom Ausmaß der Senkung von Blutzucker, Gewicht und Blutdruck auftreten, sei ein eigenständiger Wirkmechanismus zu vermuten. Die Kommentatoren diskutieren als wesentlichen Mechanismus eine Verringerung des intraglomerulären Filtrationsdrucks (9). SGLT2-Hemmer erhöhen die Glukose- und Natrium-Konzentration im distalen Nierentubulus. Über einen intrarenalen Reflexbogen resultiere eine Vasokonstriktion der afferenten Arteriolen der Glomeruli mit konsekutiver Senkung des Filtrationsdrucks und Abnahme der Proteinurie. Für diese These spricht, dass mit Can anfänglich ein rascherer Abfall der GFR beobachtet wurde. Nach 12 Monaten schneiden sich dann aber die Kurven, und nach 42 Monaten war der GFR-Abfall mit Can etwas weniger ausgeprägt (-12 vs. -17 ml/min).
Klasseneffekte? Renale Funktionsverschlechterungen als sekundäre Endpunkte wurden auch in der im Januar erschienenen DECLARE-TIMI-58-Studie mit Dapagliflozin (13) und in der EMPA-REG-Outcome mit Empagliflozin (14) untersucht. In DECLARE-TIMI 58 zeigte sich bei > 17.000 Typ-2-Diabetikern eine Reduktion renaler Ereignisse um 24% (4,3% vs. 5,6%; HR: 0,76; CI: 0,67-0,87) und in EMPA-REG Outcome mit > 7.000 Typ-2-Diabetikern um 39% (12,7% vs. 18,8%; HR: 0,61; CI: 0,53-0,70). Ähnlich wie bei den kardiovaskulären dürfte es sich als auch bei den renalen Wirkungen um einen Klasseneffekt handeln. Derzeit laufen bereits Studien, die eventuelle „nephroprotektive“ Effekte von SGLT2-Hemmern bei Nicht-Diabetikern untersuchen.
Literatur
- AMB 2006, 40, 06 Link zur Quelle . AMB 2008, 42, 35. Link zur Quelle
- AMB 2017, 51, 75. Link zur Quelle
- Neal, B., et al. (CANVAS = CANagliflozin cardioVascular Assessment Study): N. Engl. J. Med. 2017, 377, 644 Link zur Quelle . Vgl. AMB 2017, 51, 96 Link zur Quelle . AMB 2017, 51, 75. Link zur Quelle
- Rote-Hand-Brief vom 21.1.2019. Link zur Quelle (Zugriff am 31.5.2019).
- https://www.bfarm.de/SharedDocs/Risikoinformationen/ Pharmakovigilanz/DE/RHB/2016/info-sglt2.html Link zur Quelle
- https://www.bfarm.de/SharedDocs/Risikoinformationen/ Pharmakovigilanz/DE/RHB/2016/info-canagliflozin.html Link zur Quelle
- AMB 2016, 50, 52 Link zur Quelle . AMB 2017, 51, 96. Link zur Quelle
- Perkovic, V., et al. (CREDENCE = Canagliflozin and Renal Events in Diabetes with Established Nephropathy Clinical Evaluation) N. Engl. J. Med. 2019, Apr 14. Link zur Quelle
- Ingelfinger, J.R., und Rosen, C.J.: N. Engl. J. Med. 2019 Apr 14. Link zur Quelle
- Beschluss des GBA zu Invokana® vom 4.9.2014. Link zur Quelle (Zugriff am 22.5.2019).
- Freichel, M., und Mengel, K.: Antidiabetika. In: Schwabe, U., Paffrath, D., Ludwig, W.-D., Klauber, J. (Hrsg.): Arzneiverordnungs-Report 2018. Springer-Verlag, Berlin, Heidelberg. S. 359.
- EPAR Invokana®. Link zur Quelle (Zugriff am 22.5.2019).
- Wiviott, S.D., et al (DECLARE-TIMI 58 = Dapagliflozin Effect on CardiovascuLAR Events-Thrombosis In Myocardial Infarction 58): N. Engl. J. Med. 2019, 380, 347. Link zur Quelle
- Wanner, C., et al. (EMPA-REG OUTCOME = EMPAgliflozin cardiovascular outcome event trial in type 2 diabetes mellitus patients): N. Engl. J. Med. 2016, 375, 323 Link zur Quelle . Vgl. AMB 2017, 51, 75 Link zur Quelle . AMB 2015, 49, 82. Link zur Quelle